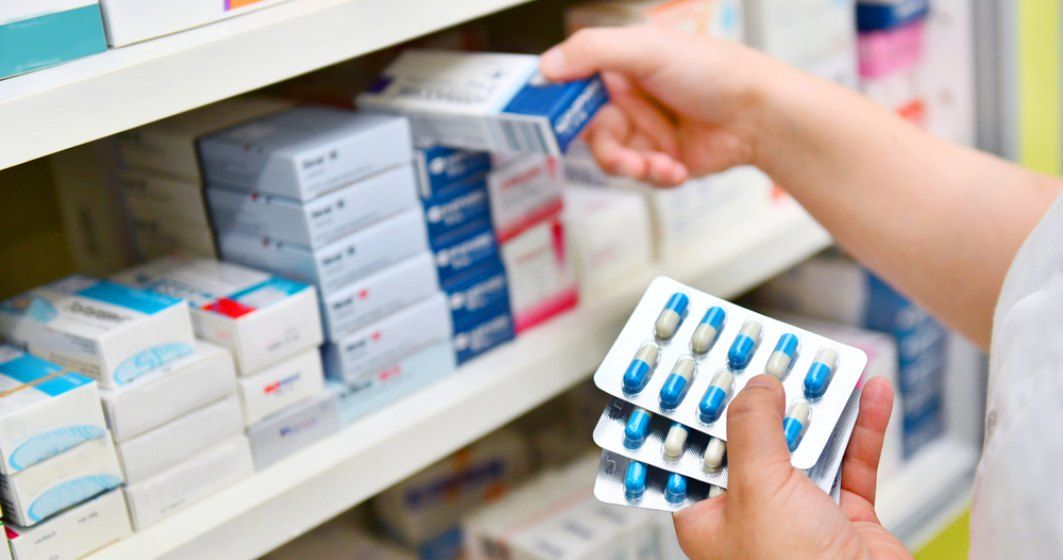
Comisia Europeană a solicitat statelor membre suspendarea autorizaţiilor pentru sute de medicamente generice, dintre care 45 sunt vândute şi în România. Toate medicamentele din listă sunt testate de compania indiană Synapse Labs, care nu ar fi respectat standardele comunităţii europene în evaluarea lor.
Decizia Comisiei Europene a fost publicată vineri, în urma unei reevaluări făcute de comitetul pentru medicamente de uz uman al Agenţiei Europene a Medicamentelor (EMA). Potrivit acesteia, o inspecţie de bună practică a evidenţiat nereguli în datele studiului realizat de Synapse Labs şi insuficienţe în documentaţia studiului şi în sistemele şi procedurile computerizate de gestionare a datelor acestuia. „Acest lucru a generat îngrijorări serioase cu privire la datele din studiile de bioechivalenţă efectuate la CRO”, arată EMA.
Comisia Europeană a anunţat că, în urma avizului EMA, „Comisia a solicitat statelor membre să suspende autorizaţia de comercializare pentru o listă de medicamente generice testate de compania indiană Synapse Labs, din cauza dovezilor insuficiente cu privire la fiabilitatea datelor de testare”. „Decizia se bazează pe o evaluare ştiinţifică efectuată de Agenţia Europeană pentru Medicamente (EMA) în urma unei cereri din partea agenţiei spaniole pentru medicamente. Aceasta din urmă a efectuat o inspecţie a laboratorului şi a informat EMA, care a realizat o analiză”, se arată în comunicatul Reprezentanţei Comisiei Europene în România.
„În urma evaluării sale ştiinţifice, EMA a stabilit că testele Synapse Labs privind aceste medicamente generice nu îndeplineau cerinţele stricte ale UE în materie de dovezi pentru a demonstra că sunt echivalente cu medicamentele de referinţă. În acord cu statele membre ale UE, autorizaţiile de comercializare naţionale vor fi suspendate până când producătorii vor putea furniza date valabile şi fiabile pentru a demonstra echivalenţa. Aceasta înseamnă furnizarea de date care să demonstreze că medicamentele generice eliberează în organism aceeaşi cantitate de substanţă activă ca medicamentele de referinţă”, se explică în comunicat.
Pentru a evita dezechilibrlee, statele membre pot amâna suspendarea acestei decizii cu până la 2 ani, în cazul medicamentelor pe care le consideră de importanţă critică la nivel naţional. Astfel, Agenţia Naţională a Medicamentului şi Dispozitivelor Medicale din România va avea un răgaz să se adapteze noilor schimbări.
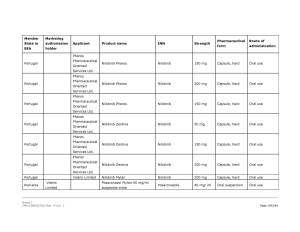
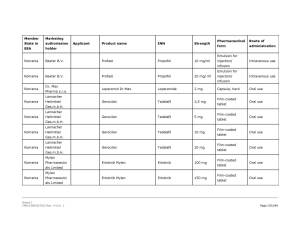
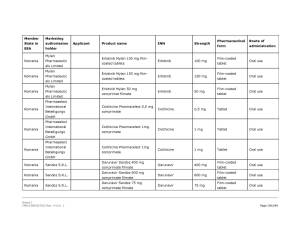
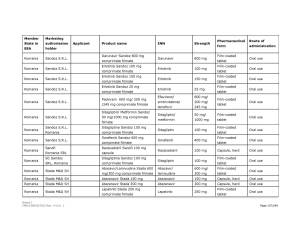
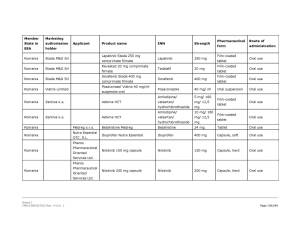
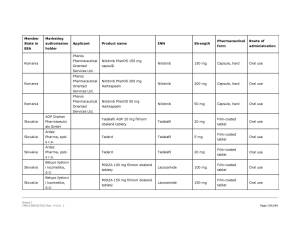
Medicamentele din România vizate de anunţul Comisiei Europene pot fi consultate în Galeria de imagini de mai jos! ↓
Pe listă se află diverse medicamente cu administrare orală sau injectabilă a companiilor Viatris Limited, Baxter BV, Dr. Max Pharma sro., Lannacher Heilmittel GmbH., Mylan Pharmaceutic als Limited, Pharmaselect International Beteiligungs GmbH, Sandoz SRL, Sanofi Romania SRL, Stada M&D SRL, Zentiva ks., deţinătoare ale autorizaţiilor de punere pe piaţă a acestora.
CE cere statelor membre să suspende autorizaţia pentru zeci de medicamente generice neconforme. Peste 45, autorizate în România
Comisia Europeană cere statelor membre să suspende autorizaţia pentru zeci de medicamente generice neconforme. Între acestea, peste 45 sunt autorizate în România. Unele, pentru tratamentul cancerului pulmonar, altele contra HIV/SIDA sau anti-diabetice. Agenţia europeană a medicamentului a luat decizia după o evaluare amănunţită, dar autorităţile naţionale pot să amâne aplicarea ei timp de doi ani pentru a evita blocajele.
Verificările făcute de Agenţia Europeană a medicamentului arată că testele făcute de o companie indiană în cazul a zeci de medicamente generice nu îndeplineau cerinţele de conformitate ale Uniunii. Astfel autorităţile au suspendat autorizaţiile. Cele mai multe substanţe active pentru medicamente sunt fabricate în India sau China.
Peste 40 de medicamente dintre cele aflate pe lista erau autorizate şi în România. Cele mai multe însă, doar pentru punere pe piaţă, fără să fie şi comercializate.
Unul dintre medicamentele ce trebuie retrase este pentru tratamentul cancerului pulmonar.
Blocaje există de mai bine de 3 ani pe piaţa medicamentelor, însă din cauza producţiei de ambalaje şi a creşterii preţurilor la plastic şi sticlă.